Jenis Arwana dan Negara Asalnya
a. Arwana Asia
Disebut sebagai ikan arwana asia karena terdapat di Asia Tenggara. Ada 4 katagori, yaitu Indonesian Red Arwana, Indonesia Red Tail Golden Arwana, Malaysian Golden Arwana,dan Green Arwana. Sebenarnyan mereka satu jenis, hanya varietas atau varian warna tubuhnya saja berbeda.Ciri khas ikan ini adalah adanya satu pasang sungut (barbel), bersisik besar dan dapat tumbuh sampai 90 cm. Ikan arowana muda memakan serangga, sedangkan yang dewasa memakan ikan. Arwana merupakan jenis pengeram telur di mulut dengan jumlah anak sekitsr 50 ekor. Waktu minimal penggadaan populasi sekitar 4,5 – 14 tahun.

Gambar 1.Scleropages formosus
b. Arwana Irian
Ukuran maksimal sekitar 1 meter, mempunyai hiasan noktah titik - titik sehingga disebut Spoted bonytounge. Ikan ini terdapat di sungai Fitzroy Queensland, Australia dan melimpah di Papua sehingga disebut Arowana Irian.Arwana ini hidup di air menggenang, terutama di anak – anak sungai.Hidup di permukaan sungai dekat vegetasi air. Ikan territorial dan agresif terhadap ikan lain. Ikan predator dan kawin saat musim hujan dengan suhu 20-30 derajat celcius.

Gambar 2. Scleropages formasus
c. Arwana Australia
Ukuran maksimal sekitar 1 meter. Pernah dilaporkan mempunyei berat sekitar 12,5 kg, hidup di air menggenang, di anak-anak sungai dan rawa-rawa hutan. Seperti arowana lain, jenis ini juga hidup di prmukaan sungai dekat vegetasi air. Ikan territorial,agresif terhadap ikan lain. Musim kawin saat musim hujan dengan suhu sekitar 30oC. Ikan ini mengerami anaknya di mulut.Jumlah telur sekitar 30-130 ekor.

Gambar 3. Scleropages jardini
d. Arwana Brazil Silver
Mempunyai ukuran maksimal 1,2 meter, berwarna keperakkan (silver) dan sirip-sirip cerah kemerahan. Distribusi dan habitat dialam terdapat di Sungai Amazone, Rupununi dan Oyapock di Amerika Selatan.Hidup di air menggenang, di anak-anak sungai. Hidup dipermukaan sungai dekat vegetasi air, ikan territorial,agresif terhadap ikan lain.
Ikan ini adalah kelompok predator yang menyerap ikan, udang,reptile,mamalia air,dan serangga dengan melompat keluar air.

Gambar 4. AnakanOsteoglossum bicirrhosum
e. Arwana Brazil Black
Dapat tumbuh sampai 1 meter, berwarna keperakkan (Silver) dengan sirip kehitaman.Saat kecil mempunyai gelembung hitam seperti kutil yang di bawah tutup insangnya.Hidup di Sungai Negro di Amerika Selatan.Hidup di air menggenang, sering ada dipermukaan sungai dekat vegetasi air. Ikan territorial, agresif terhadap ikan lain. Ikan predator yang memakan ikan, udang serta serangga yang ditangkap dengan cara melompat keluar dari air.
f. Arwana Aureus
Terdapat di Indonesia dan layak disebut sebagai ikan arwana Indonesia.Ikan ini baru ditemukan pada 2003 oleh beberapa ahli ikan dari luar dan dalam negeri. Anak ikan yang ada didalam mulut induknya bisa mencapai 100 ekor.
Sumber:
Suharyadi, 2011. Budidaya Ikan Arwana: Modul Penyuluhan Perikanan. Jakarta, Pusat Penyuluhan Kelautan dan Perikanan BPSDMKP.
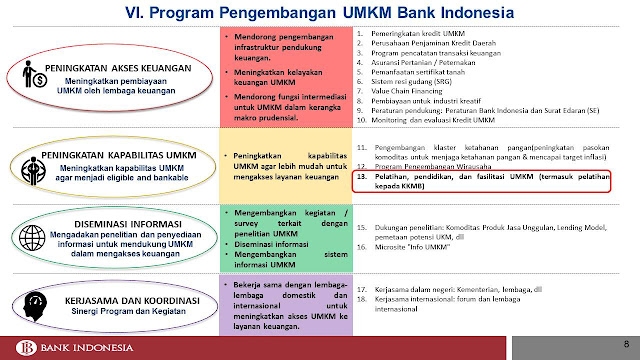
PERAN BANK INDONESIA DALAM MENGAKSELERASI EKSESE KEUANGAN UMKM MELALUI KONSULTAN KEUANGAN MITRA BANK (KKMB)
Sumber: Bank Indonesia, 2016
ANALISA USAHA PEMBESARAN IKAN NILA BERSAMA TOMAT
Akuaponik secara sederhana dapat diartikan menjadi sistim terpadu antara Akuakultur (budidaya ikan) dan Hidroponik (budidaya flora non-tanah) atau teknologi budidaya yg mengkombinasikan pemeliharaan ikan dengan tumbuhan.
Sejak tahun 2005 teknik budidaya ikan air tawar dengan sistim akuaponik telah dikembangkan di Balai Penelitian dan Pengembangan Budidaya Air Tawar, Bogor sebagai solusi dari semakin terbatasnya lahan dan sumber air bagi kegiatan budidaya ikan khususnya di perkotaan.
Dengan teknologi akuaponik, pencemaran air dampak limbah budidaya (sisa pakan dan metabolisme ikan, penyebab tingginya N & P dalam air) akan diserap dan dimanfaatkan sang akar sebagai sumber nutrien bagi tumbuhan. Akibat menurut mekanisme tersebut maka air yg digunakan sebagai media budidaya ikan akan terpurifikasi sehingga tidak perlu diganti selama periode pemeliharaan (hanya perlu ditambah untuk mengubah air yang hilang dampak penguapan).
Dari hasil penelitian ternyata budidaya dengan sistim akuaponik mampu menghemat air sebesar 700% (Ahmad dkk, 2005), dapat mereduksi ammonia dalam air hingga 90% serta menurunkan kadar nitrit dari 4,4 mg/l menjadi 0,013-0,25 mg/l (Nugroho dan Sutrisno, 2002). Selain itu, akuaponik juga dapat dilakukan pada daerah dengan ketinggian 7 – 1000 m DPL (Taufik, 2012), artinya teknologi ini dapat diterapkan pada semua daerah mulai dari pesisir hingga pegunungan.
Untuk memberikan citra tentang peluang pengembangan akuaponik, maka bisa ditinjau Analisa Usaha Pembesaran Ikan Nila Bersama Tomat menjadi berikut:
NO. | URAIAN | VOLUME | SATUAN | HARGA SATUAN | JUMLAH |
1. | INVESTASI | ||||
a. | Pembuatan/pembelian wadah budidaya |
- Kolam Terpal 4 X 6 M (JUE = 2 tahun = 24 bulan)
1
butir
400.000
400.000
b.
Peralatan
- Mesin Pompa Air (JUE = 3 tahun = 36 bulan)
1
butir
150.000
150.000
- Pipa PVC 1/2" (JUE = 3 tahun = 36 bulan)
6
btg
1lima.000
90.000
- Knee 1/2" (JUE = 3 tahun = 36 bulan)
12
butir
4.500
54.000
- Ember 10 L (JUE = dua tahun = 24 bulan)
30
butir
7.500
22lima.000
- Batu apung (JUE = 3 tahun = 36 bulan)
45
kg
9.000
40lima.000
JUMLAH 1 (INVESTASI)
1.324.000
2.
BIAYA TETAP
a.
Penyusutan Wadah Budidaya
- Kolam Terpal 4 X 6 M (JUE = 2 tahun = 24 bulan)
4
bulan
16.667
66.667
b.
Penyusutan Peralatan
- Mesin Pompa Air (JUE = 3 tahun = 36 bulan)
4
bulan
12.000
48.000
- Pipa PVC 1/2" (JUE = 3 tahun = 36 bulan)
4
bulan
2.500
10.000
- Knee 1/2" (JUE = 3 tahun = 36 bulan)
4
bulan
1.050
4.200
- Ember 10 L (JUE = dua tahun = 24 bulan)
4
bulan
9.375
37.500
- Batu apung (JUE = 3 tahun = 36 bulan)
4
bulan
11.250
4lima.000
c.
Gaji Tenaga Kerja
4
orang/bulan
100.000
400.000
d.
Listrik (20 - 30 watt x 24 jam x 30 hari)
4
bulan
20.000
80.000
JUMLAH 2 (BIAYA TETAP)
691.367
3.
BIAYA VARIABEL (OPERASIONAL)
a.
Benih
- Benih Ikan Nila; Ukuran 3 - 5
1.500
ekor
75
112.500
- Benih Tomat
30
unit
lima.000
150.000
c.
Pakan
- Pakan Pabrik
125
kg
8.500
1.062.500
d.
Bahan-bahan habis gunakan
- Probiotik
1
liter
2lima.000
2lima.000
- Obat-obatan ikan
1
paket
50.000
50.000
- Media filter
20
unit
7.500
150.000
JUMLAH 3 (BIAYA OPERASIONAL)
1.550.000
4.
BIAYA TOTAL (TETAP VARIABEL)
dua.241.367
- Nila = Rp. 1.540.667
- Tomat = Rp. 550.700
lima.
PENERIMAAN
- Panen Nila (Size 7 - 10)
100
kg
16.000
1.600.000
- Panen Tomat (2 bln x 2 musim x 30 unit x 1 kg)
120
kg
10.000
1.200.000
JUMLAH 5
2.800.000
6.
KEUNTUNGAN = (PENERIMAAN - BIAYA TOTAL)
558.633
- Nila = Rp. 59.333
- Tomat = Rp. 649.300
7.
KEUNTUNGAN (JIKA TENAGA KERJA TIDAK DIBAYAR)
958.633
8.
ANALISA-ANALISA
IKAN NILA
- Harga Pokok Penjualan = (porto total/volume prod)
Rp./satuan
1lima.407
- R/C ratio = (penerimaan/biaya total)
-
1
- B/C ratio = (keuntungan/biaya total)
-
0
- Payback Period = (investasi/keuntungan)
kali bisnis
9
- Net Interest Margin = keuntungn/penerimn x 100)
%
5
TOMAT
- Harga Pokok Penjualan = (porto total/volume prod)
Rp./satuan
4.589
- R/C ratio = (penerimaan/biaya total)
-
2,2
- B/C ratio = (keuntungan/biaya total)
-
1,dua
- Payback Period = (investasi/keuntungan)
kali bisnis
1
- Net Interest Margin = keuntungn/penerimn x 100)
%
54
Sumber:
BPPBAT Bogor, 2014. Akuaponik: Teknik Budidaya Hemat air dan Lahan. Bogor, Balai Penelitian & Pengembangan Budidaya Air Tawar.
Http://pusluh.Kkp.Go.Id/mfce/halaman-album-46-perikanan-budidaya-html diakses dalam 09/08/2016.
Https://www.Google.Co.Id/search
Sutrisno, dkk. 2013. Teknologi Budidaya Ikan Air Tawar Sistem Akuaponik. Buku Rekomendasi Teknologi Kelautan dan Perikanan Halaman 188-199; Jakarta, Sekretariat Badan Penelitian dan Pengembangan Kelautan dan Perikanan Kementerian Kelautan dan Perikanan.
PEMBENIHAN IKAN GURAME SECARA ALAMIAH
Cara Pemijahan Budidaya Ikan Gurame (Osphronemus gouramy). Gurame adalah jenis ikan konsumsi bergizi tinggi yang termasuk jenis ikan air tawar dengan daya tahan tubuh yang tinggi. Gurame atau Osphronemus gouramy memiliki bentuk badan pipih lebar, bagian punggung berwarna merahsawo dan bagian perut berwarnakekuningkuningan/ keperak-perakan. Ikan gurame merupakan keluarga Anabantidae, keturunan Helostoma dan bangsa Labyrinthici.
Guramme bisa tumbuh baik dengan ketinggian 20-400 m dpl. Gurame mudah dibudidayakan tetapi did dataran tinggi lebih kurang 800 m dpl ikan gurame cenderung lambat pertumbuhannya.
Parameter Ikan Gurame
Suhu Oksigen pH Jumlah Telur
25-30 >4 6-8 2000-10.000
Pemilihan Induk Gurame
Induk mencapai umur > 3 - 7 tahun. Berbeda dengan induk ikan tambakan, Jumlah telur induk ikan gurame tergantung dari berat indukan betina semakin besar indukan betina semakin banyak jumlah telur yang tersimpan, perut akan membulat dan relatif penjang dengan warna badan terang. Sisik-sisiknya usahakan tidak cacat/hilang dan masih dalam keadaan tersusun rapi.
Induk betina yang relatif umur dan matang kelamin ditandai dengan perutnya akan membesar ke belakang atau di dekat lubang dubur. Pada lubang anus akan nampak putih kemerah-merahan. Dan bila kita coba buat meraba perutnya akan teras lembek.
Ciri-Ciri indukan Gurame
1) Induk betina
Ikan betina mempunyai dasar sirip dada yang gelap atau berwarna kehitaman, rona dagu ikan betina keputih-putihan atau sedikit coklat, bila diletakkan di lantai maka ikan betina tidak menerangkan reaksi apa-apa.
2) Induk jantan
Ikan jantan mempunyai dasar sirip berwarna terperinci atau keputih-putihan, mempunyai dagu yg berwarna kuning, lebih tebal daripada betina & menjulur. Induk jantan apabila diletakkan dalam lantai atau tanah akan menerangkan reaksinya dengan cara mengangkat pangkal sirip ekornya ke atas.
Klasifikasi ikan gurame adalah menjadi berikut:
Klas : Pisces
Sub Kelas : Teleostei
Ordo : Labyrinthici
Sub Ordo : Anabantoidae
Famili : Anabantidae
Genus : Osphronemus
Species : Osphronemus goramy (Lacepede)
Syarat Lokasi Budidaya Ikan Gurame
Tanah yang baik buat kolam pemeliharaan merupakan jenis tanah liat/lempung, nir berporos dan cukup mengandung humus. Jenis tanah tadi dapat menunda massa air yg besar & nir bocor sebagai akibatnya dapat dibentuk pematang/dinding kolam.
Kemiringan tanah yg baik untuk pembuatan kolam berkisar antara 3-5% buat memudahkan pengairan kolam secara gravitasi.
Ikan gurame bisa tumbuh normal, jika lokasi pemeliharaan berada pada ketinggian 50-400 m dpl.
Kualitas air buat pemeliharaan ikan gurame wajib higienis dan dasar kolam tidak berlumpur, nir terlalu keruh & nir ternoda bahan-bahan kimia beracun, & minyak/limbah pabrik.
Kolam menggunakan kedalaman 70-100 cm & sistem pengairannya yang mengalir sangat baik bagi pertumbuhan dan perkembangan fisik ikan gurame. Untuk pemeliharaan secara tradisional dalam kolam khusus, debit air yang diperkenankan adalah 3 liter/detik, sedangkan buat pemeliharaan secara polikultur, debit air yg ideal adalah antara 6-12 liter/dtk.
Keasaman air (pH) yang baik merupakan antara 6,lima-8.
Suhu air yang baik berkisar antara 25-28 derajat C.
Penyiapan Sarana & Peralatan Ikan Gurame
Jenis kolam yang generik digunakan dalam budidaya ikan gurame antara lain:
a) Kolam penyimpanan induk
Kolam ini berfungsi buat menyimpan induk pada mempersiapkan kematangan telur & memelihara kesehatan induk, kolam berupa kolam tanah yg luasnya sekitar 10 meter persegi, kedalamam minimal 50 centimeter & kepadatan kolam induk 20 ekor betina & 10 ekor jantan.
B) Kolam pemijahan
Kolam berupa kolam tanah yang luasnya 200/300 meter persegi dan kepadatan kolam induk 1 ekor memerlukan 2-10 meter persegi (tergantung menurut sistim pemijahan). Adapun syarat kolam pemijahan
adalah suhu air berkisar antara 24-28 derajat C; kedalaman air 75-100 cm; dasar kolam sebaiknya berpasir. Tempatkan sarana penempel telur berupa injuk atau ranting-ranting.
C) Kolam pemeliharaan benih/kolam pendederan
Luas kolam tidak lebih berdasarkan 50-100 meter persegi. Kedalaman air kolam antara 30-50 centimeter. Kepadatan usahakan lima-50 ekor/meter persegi. Lama pemeliharaan di pada kolam pendederan/ipukan antara 3-4 minggu, pada waktu benih ikan berukuran 3-lima centimeter.
D) Kolam pembesaran
Kolam pembesaran berfungsi sebagai tempat untuk memelihara & membesarkan benih selepas berdasarkan kolam pendederan. Adakalanya dalam pemeliharaan ini dibutuhkan beberapa kolam jaring 1,25?1,lima centimeter. Jumlah penebaran bibit sebaiknya nir lebih berdasarkan 10 ekor/meter persegi.
E) Kolam/loka pemberokan
Merupakan tempat pembersihan ikan sebelum dipasarkan
Adapun cara pembuatan kolam merupakan sebagai berikut:
Ukurlah tanah 10 x 10 m (100 m2).
Buatlah pematangnya dengan ukuran; permukaan lebarnya 0,lima m, bagian bawahnya 1 m & tingginya 1 m.
Pasanglah pipa/bambu besar buat pemasukan & pengeluaran air. Aturlah tinggi rendahnya, agar mudah memasukkan & mengeluarkan air.
Cangkullah tanah dasar kolam induk agar gembur, kemudian diratakan lagi. Tanah akan jadi lembut setelah diairi, sebagai akibatnya lobang-lobang tanah akan tertutup, dan air nir keluar dampak bocor dari pori-pori itu. Dasar kolam dibuat miring ke arah pintu keluar air.
Buatlah saluran ditengah-tengah kolam induk, memanjang dari pintu masuk air ke pintu keluar. Lebar saluran itu 0,lima m & dalamnya 15 centimeter.
Keringkanlah kolam induk menggunakan 2 karung pupuk kandang yang disebarkan merata, kemudian air dimasukkan. Biarkan selama 1 minggu, supaya pupuk hancur & meresap ke tanah dan membentuk lumut, serta menguji supaya kolam tidask bocor. Tinggi air 0,75-1 m.
Peralatan Ikan Gurame
Alat-alat yang biasa digunakan pada bisnis pembenihan ikan gurame antara lain merupakan:
jala,
waring (anco),
hapa (kotak berdasarkan jaring/kelambu buat menampung sementara induk juga benih),
seser,
ember-ember,
baskom banyak sekali berukuran,
timbangan skala mini (gr) dan akbar (Kg),
cangkul,
arit,
pisau serta piring secchi (secchi disc) buat mengukur kadar kekeruhan.
Sedangkan alat-alat lain yg digunakan buat memanen/menangkap ikan gurame antara lain merupakan
warring/scoopnet yg halus,
ayakan panglembangan diameter 100 centimeter,
ayakan penandean diameter 5 cm,
loka menyimpan ikan, keramba kemplung,
keramba kupyak, fish bus (buat mengangkut ikan jarak dekat),
kekaban (buat loka penempelan telur yg bersifat inheren),
hapa menurut kain tricote (buat penetasan telur secara terkontrol) atau kadang-kadang untuk penangkapan benih,
ayakan penyabetan dari alumunium/bambu,
oblok/delok (buat pengangkut benih),
sirib (buat menangkap benih berukuran 10 cm keatas),
anco/hanco (buat menangkap ikan),
lambit menurut jaring nilon (buat menangkap ikan konsumsi),
scoopnet (buat menangkap benih ikan yang berumur satu minggu keatas),
seser (gunanya= scoopnet, tetapi ukurannya lebih besar ),
jaring berbentuk segiempat (buat menangkap induk ikan atau ikan konsumsi).
Pemeliharaan Induk Ikan Gurame
Induk-induk terpilih (20-30 ekor buat kolam seluas 10 m2) disimpan dalam kolam penyimpanan induk. Beri makanan selama pada penampungan. Untuk setiap induk dengan berat antara 2-tiga kg diberi kuliner daun-daunan sebesar 1/3 kg setiap hari pada sore hari. Makanan tambahan berupa dedak halus yang diseduh air panas diberikan 2 kali seminggu dengan dosis 1/dua blekminyak tanah setiap kali anugerah.
Pembenihan Ikan Gurame
Induk yang telah matang gonad siap buat ditebarkan pada kolam pemijahan.
Kolam pemijahan merupakan kolam spesifik yg ukurannya tergantung jumlah induk yg dimiliki, berukuran minimumya 20 m2 & maksimum dapat mencapai 1000 m2 menggunakan kedalaman ideal 0,8 m - 1,5 m.
Kolam induk sebaiknya dekat menggunakan kolam pemijahan sebagai akibatnya memudahkan proses pemindahan induk ikan.
Padat tebar induk ikan gurami diusahakan 1 ekor induk ikan yg bobotnya tiga-lima kg per ekor usahakan memiliki areal buat beranjak bebas seluas 5 m2.
Penebaran induk dilakukan dengan perbandingan 1 ekor jantan yang bobotnya mencapai tiga-lima kg dan tiga ekor betina yang bobotnya minimal tiga kg.
Proses pemijahan umumnya akan berlangsung yang diawali 1 minggu pertama induk jantan sudah memulai membuat sarang, lamanya membuat sarang kurang lebih 6 hari kemudian induk betina yg sudah siap pijah memiliki naluri akan segera berpijah sesudah sarangya siap, terjadinya proses pemijahan selama 2-tiga hari, induk betina segera mengeluarkan telur-telurnya dan secara bersamaan jua induk jantan menyemprotkan sperma & terjadi proses pembuahan telur oleh sperma jantan.
Proses perkawinan akan diakhiri jika jantan telah menutup sarang, dengan ijuk atau sejenisnya. Keberhasilan proses pemijahan dapat diamati pula dengan melihat pemukaan kolam yg ada sarang guraminya terlihat keluar banyak minyak dipermukaan air & tecium bau amis.
Penetasan Telur Ikan Gurame
Pengambilan sarang yg berisi telur dilakukan secara berhati-hati dengan cara memegang sisi luar bagian paling bawah sarang dan sebaiknya sarang tidak diangkat begitu saja, tetapi menggunakan wadah berupa ember atau baskom yg berisi air dan diberi Metheline Blue menggunakan perbandingan 5 cc obat buat lima liter air.
Penetasan dapat dilakukan di pada paso atau baskom juga pada pada akuarium. Air pada pada baskom atau akuarium diberi aerasi atau supplay oksigen & setiap hari dilakukan pengambilan telur-telur yang tidak menetas atau berjamur supaya tidak menular ke telur yang sehat. Biasanya telur gurami akan menetas sesudah 36-41 jam.
Pemeliharaan Larva Ikan Gurame
Setelah telur menetas, larva bisa dipelihara pada paso atau baskom selama 8-10 hari sampai kuning telur habis.
Bila penetasan dilakukan di pada akuarium, pemindahan larva nir perlu dilakukan. Selama pemeliharaan di akuarium, penggantian air perlu dilakukan buat membersihkan air menurut minyak yg didapatkan saat penetasan. Suhu dipertahankan dalam kisaran 29-30 derajat celcius.
Pemindahan larva berdasarkan lokasi penetasan ke lokasi pembesaran / pendederan bisa dilakukan menggunakan memakai baskom atau ember.
Larva dimasukkan ke dalam ember beserta air berdasarkan loka penetasan sehingga larva nir stres. Sebaiknya pemindahan ke kolam atau loka pendederan dilakukan pada pagi atau sore hari dimana pebedaan suhu antara air media penetasan & air media pendederan atau kolam nir begitu mencolok.
Pemberian Pakan Ikan Gurame
Pakan mulai diberikan selesainya larva berumur 8-10 hari atau selesainya kuning telur habis. Pakan yang diberikan adalah pakan alami yg bisa berupa artemia, kutu air berupa daphina atau moina, cacing sutera.
Jenis pakan yang diberikan ini disesuaikan dengan bukaan verbal larva. Frekuensi hadiah sebesar 4-5 kali sehari.
Untuk larva yang dipelihara pada akuarium, pemberian pakan bisa diberikan sebesar 2 sdm buat 1000 ekor larva setiap anugerah. Ketika telah semakin akbar, kepadatan larva pada satu akuarium dapat dikurangi.
Larva yg dipelihara dalam akuarium selanjutnya dipelihara sampai menjadi benih yang siap ditebarkan ke kolam pemeliharaan benih.
Pertarunga Pembenihan Ikan Gurame
Berikut ini beberapa permasalahan yg acapkali ditemui pada usaha pembenihan ikan gurami :
1. Induk Malas Memijah
Induk gurami yang sudah matang gonad kadang-kadang tidak mau memijah. Hal ini sebagian besar diakibatkan lantaran kondisi lingkungan kolan yang nir nyaman bagi indukan atau indukan belum sahih-benar matang gonad. Cara mengatasinya merupakan menggunakan memijahkan induk yang sahih-benar sudah matang gonad & kolam pemijahan jangan terlalu padat, cukup 40 ekor/1000 m2 atau bisa juga menggunakan perbandingan tiga betina : 1 jantan buat kolam dengan ukuran 4m x 3m.
2. Jumlah Telur Sedikit
Hal ini bisa disebabkan oleh umur induk yang terlalu muda. Untuk mengatasinya adalah dengan menggunakan induk jantan yang telah berumur 4 tahun dan induk betina yang berumur 3 tahun.
Tiga. Telur Tidak Menetas
Telur yg tidak menetas bisa disebabkan oleh kualitas induk yg kurang bagus & penanganan sarang yg galat sehingga telur tewas. Hal ini bisa diatasi dengan penggunaan induk yg kualitasnya sahih-benar memenuhi syarat sebagai akibatnya telur yg didapatkan indah mutunya dan tidak mengangkat baskom atau ember begitu saja akan namun sarang diangkat beserta menggunakan air kolam pemijahan agar telur tidak terkotori dengan udara luar.
4. Tubuh Benih Berwarna Hitam
Kondisi ini disebabkan sang gangguan velvet yg mengakibatkan kulit benih sebagai berwarna gelap & berlendir. Pemicunya merupakan lantaran suhu air penetasan terlalu rendah. Hal ini bisa diatasi menggunakan pemasangan pemanas atau heater buat menjaga suhu air media penetasan tetap dalam kisaran yang sesuai.
Sumber:
http://www.Alamikan.Com/2014/05/cara-pembenihan-budidaya-ikan-gurame.Html
http://budidayanews.Blogspot.Co.Id/2011/02/cara-pemijahan-ikan-gurame.Html
PEMBERIAN PAKAN DAN PEMANENAN PADA BUDIDAYA CHLORELLA (PAKAN ALAMI)
Chlorella merupakan salah satu jenis fitoplankton yang banyak digunakan untuk berbagai keperluan, salah satunya digunakan sebagai makanan rotifera atau sebagai media budidaya larva ikan.
Budidaya Chlorella dapat dilakukan dalam skala laboratorium dan skala lapangan. Dalam budidaya Chlorella di skala laboratorium digunakan wadah berupa erlenmeyer. Hasil budidaya pada skala laboratorium pada umumnya digunakan sebagai stock untuk budidaya massal. Dalam kegiatan budidaya skala laboratorium wadah harus dibersihkan dan disanitasi. Umumnya pencucian dapat menggunakan deterjen dan dibilas sampai bersih kemudian dikeringkan. Setelah kering kemudian wadah disanitasikan dengan cara direbus pada suhu 1100C.
Air yang digunakan juga harus bersih. Air yang digunakan dapat berupa air sumur atau air mata air atau akuades. Untuk air mata air atau air sumur sebaik air difilter terlebih dahulu untuk menyaring partikel yang tersuspensi dalam air. Selajutnya air juga harus disanitasi dengan cara merebus air sampai mendidih, sehingga air yang digunakan bebas dari kontaminasi plankton lain. Selanjutnya erlenmeyer yang sudah diisi air sebanyak satu liter ditempatkan pada rak yang dilengkapi dengan selang aerasi dan lampu neon. Hal ini dilakukan supaya cahaya cukup untuk proses fotosintesis Chlorella, yang memerlukan intensitas cahaya antara 2500 – 5000 lux dan agar Chlorella tidak mengendap. Dalam budidaya di dalam laboratorium sebaiknya dilakukan pada suhu antara 21-250C, dengan tujuan agar pertumbuhannya tidak terlalu cepat.
Setelah persiapan wadah selesai kemudian dilakukan pemupukan. Pemupukan ini dilakukan agar kebutuhan unsur hara dari Chlorella terpenuhi sehingga Chlorella dapat berkembang. Adapun pupuk yang dapat digunakan untuk skala laboratorium ini adalah pupuk Walne, seperti yang tertera pada Tabel 1. Gunakan 1 ml larutan A pada Tabel 1 tersebut untuk setiap liter media budidaya.
Tabel 1. Komposisi pupuk Walne buat phytoplankton
Untuk budidaya Chlorella skala massal dapat digunakan wadah berupa bak fiber atau bak beton yang berbentuk bulat atau persegi.
Volume wadah untuk budidaya Chlorella secara massal berkisar antara 500 l (minimal) dan 200 ton. Selanjutnya kedalaman air minimal dalam wadah budidaya adalah 40 cm. Hal ini dimaksudkan agar suhu dalam wadah tidak terlalu tinggi pada siang hari dan tidak terlalu dingin pada malam hari.
Untuk skala masal wadah biasanya ditempatkan pada luar ruangan dan mendpat cukup cahaya surya
Dalam budidaya Chlorella skala massal disamping volume dan kedalaman air, bentuk permukaan bak juga harus mendapatkan perhatian. Permukaan bak sebaiknya mampunyai bentuk yang licin agar supaya mudah dibersihkan dari kotoran atau lumut. Bak dibersihkan dengan cara menyikat dinding dan dasar bak sampai semua kotoran hilang.
Sama halnya seperti budidaya dalam laboratorium, air yg akan dipakai pada budidaya massal jua wajib disanitasi. Pada umumnya air tawar yg digunakan bisa bersumber berdasarkan air sumur. Air yang digunakan terlebih dahulu dibersikan menggunakan jalan penyaringan (pencucian air secara fisik). Penyaringan air tawar dapat dilakukan menggunakan filter pasir sebelum masuk ke dalam bak budidaya & pada ujung saluran/selang air yang akan dimasukkan ke bak, perlu diberi kantung penyaring dengan berukuran lubang 25 mm. Hal ini dilakukan untukmencegah masuknya zooplankton melalui air yang akan memakan fitoplankton. Setelah air disaring secara fisik air jua harus disanitasi buat mematikan fitoplankton lain dan telur-telur zooplankton yg lolos saringan.
Sanitasi dapat dilakukan menggunakan menggunakan chlorine dengan takaran 30 ppm (30 g/ton air). Pada umumnya bak budidaya diisi air sebesar 85-90% dari kapasitas. Sebagai contoh dalam bak berukuran 20 ton, hanya diisi air tawar sebanyak 18 ton. Air disanitasi dengan memakai chlorine 30 ppm selama 6 jam. Setelah chlorine dimasukkan, air diaerasi sampai chlorine tercampur rata diseluruh badan air dan sesudah itu aerasi dimatikan. Untuk menetralkan chlorine, air diberi Na?Thiosulfate 10 ppm dan diaerasi kuat.
Setelah air dibersihkan dan disanitasi kemudian air diaeresi kembali. Untuk bak berukuran besar sebaiknya setiap jarak 1 meter diberi satu titik aerasi. Setelah air diaerasi kemudian dilakukan pemupukan. Pemupukan dilakukan dengan tujuan agar unsur hara yang dibutuhan Chlorella dapat terpenuhi sehingga dapat menghasilkan Chlorella dengan kepadatan yang tinggi. Adapun pupuk yang digunakan untuk skala masal berbeda dengan pupuk yang digunakan dalam skala laboratorium. Hal ini dilakukan dengan pertimbangan faktor ekonomis.
Adapun pupuk yg dipakai dalam skala massal bisa ditinjau dalam Tabel 2.
Tabel 2. Berbagai kombinasi pupuk untuk media Chlorella
Sesuai bahan yang tersedia, jenis pupuk yang akan digunakan dapat dipilih diantara kombinasi pupuk di atas. Satu hari setelah pemupukan kemudian bibit Chlorella dapat ditebar. Jumlah bibit yang ditebar harus mencukupi. Sebagai contoh bibit dengan volume 1 liter tidak bisa digunakan untuk dijadikan bibit pada skala massal. Hal ini disebabkan pencapaian waktu yang dibutuhkan untuk mencapai popolasi puncak lama. Oleh karena itu perlu dilakukan upscaling ( budidaya pada volume wadah yang berurutan mulai dari yang terkecil sampai terbesar) yang akan dijelaskan kemudian.
Selama budidaya Chlorella dilakukan, aerasi perlu diberikan agar terjadi pencampuran air, sehingga semua sel Chlorella bisa mendapatkan pupuk yang diperlukan. Selain itu aerasi berguna untuk menghindari stratifikasi suhu air, dan memberikan kesempatan terjadinya pertukaran gas, dimana udara adalah sebagai sumber gas CO2 untuk keperluan fotosintesis Chlorella, sekaligus untuk mencegah naiknya pH air. Fitoplankton dapat mentolerir pH air 7–9 dan optimum pada pH 8,2 – 8,7.
SUMBER:
Jusadi D., 2003. Modul Budidaya Rotifera - Budidaya Pakan Alami Air Tawar. Direktorat Pendidikan Menengah Kejuruan, Direktorat Jenderal Pendidikan Dasar dan Menengah, Jakarta.
Coutteau, P. 1996. Micro?Algae, p. 7?48. In P. Lavens and P. Sorgeloos (eds) Manual on the production and used of live food for aquaculture. FAO Fisheries Technical Paper 361..
PENETASAN KISTA ARTEMIA (PAKAN ALAMI)

Penetasan kista Artemia adalah suatu proses inkubasi kista Artemia di media penetasan (air laut ataupun air laut buatan) sampai menetas. Proses penetasan terdiri dari beberapa tahapan yang membutuhkan waktu sekitar 18-24 jam.
A. Proses penyerapan air
b. Pemecahan dinding cyste sang embrio
c. Embrio terlihat jelas masih diselimuti membran
d. Menetas dimana nauplius berenang bebas
Beberapa hal yang harus diperhatikan dalam menetaskan cyste Artemia adalah: Aerasi, Suhu, Kadar garam, Kepadatan cyste dan Cahaya
Agar diperoleh hasil penetasan yg baik maka oksigen terlarut di pada air harus lebih menurut lima ppm. Untuk mencapai nilai tadi bisa dilakukan dengan pengaerasian yang kuat. Disamping buat meningkatkan oksigen, pengaerasian jua berguna agar cyste yang sedang ditetaskan nir mengendap.
Suhu sangat mempengaruhi lamanya waktu penetasan dan suhu optimal untuk penetasan Artemia adalah 26-290C. Pada suhu dibawah 250C Artemia akan membutuhkan waktu yang lebih lama untuk menetas dan pada suhu diatas 33oC dapat menyebabkan kematian cyste. Kadargaram optimal untuk penetasan adalah antara 5 – 35 ppt, namun untuk keperluan praktis biasanya digunakan air laut (kadar garam antara 25–35 ppt). Nilai pH air harus dipertahankan pada nilai 8 agar diperoleh penetasan yang optimal. Adapun iluminasi pada saat penetasan sebaiknya 2000 lux.
Hal lain yang menentukan derajat penetasan cyste adalah kepadatan cyste yang akan ditetaskan. Pada penetasan skala kecil (volume < 20l) kepadatan cyste dapat mencapai 5 g per liter air. Akan tetapi pada skala yang lebih besar agar diperoleh daya tetas yang baik maka kepadatan harus diturunkan menjadi 2 g per liter air.
Artemia akan menetas setelah 18-24 jam. Artemia yang sudah menetas dapat diketahui secara sederhana yakni dengan melihat perubahan warna di media penetasan. Artemia yang belum menetas pada umumnya berwarna cokelat muda, akan tetapi setelah menetas warna media berubah menjadi oranye. Warna oranye belum menjamin Artemia sudah menetas sempurna, oleh karena itu untuk meyakinkan bahwa Artemia sudah menetas secara sempurna disamping melihat perubahan warna juga dengan mengambil contoh Artemia dengan menggunakan beaker glass. Jika seluruh nauplius Artemia sudah berenang bebas maka itu menunjukkan penetasan selesai. Akan tetapi jika masih banyak yang terbungkus membran, maka harus ditunggu 1-2 jam agar semua Artemia menetas secara sempurna.
Kista menetas menjadi Artemia stadia nauplius. Setelah menetas sempurna, secara visual dapat terlihat terjadinya perubahan warna dari coklat muda menjadi oranye. Hal yang penting yang perlu diperhatikan dalam pemanenan nauplius Artemia adalah jangan sampai tercampur antara Artemia dan cangkang. Hal ini perlu dihindari mengingat cangkang Artemia tersebut mengandung bahan organik yang dapat menjadi substrat perkembangbiakan bakteri.
Setelah 18 jam dimasukan dalam bak penetasan maka pengecekan apakah Artemia dalam wadah penetasan sudah menetas atau belum.
Pengecekan dilakukan dengan cara mematikan aerasi. Sesaat selesainya aerasi dimatikan, apabila secara kasat mata holistik nauplius sudah berenang bebas maka pemanenan dapat dilakukan & aerasi permanen dimatikan. Jika sebagian besar nauplius masih terbungkus membran dan belum berenang bebas maka aerasi dihidupkan pulang. Selanjutnya 1 atau dua jam lalu dilakukan pengecekan ulang.
Langkah awal pemanenan Artemia yaitu dengan mematikan aerasi serta menutup bagian atas wadah dengan bahan yang tidak tembus cahaya. Hal ini dilakukan dengan tujuan memisahkan antara nauplius dan cangkang Artemia. Cangkang Artemia akan mengambang dan berkumpul di permukaan air. Nauplius Artemia akan berenang menuju ke arah cahaya. Karena bagian bawah wadah tranparan dan ditembus cahaya maka nauplius Artemia akan berkumpul di dasar wadah penetasan. Oleh karena itu pada saat pemanenan nauplius, sebaiknya bagian dasar wadah disinari lampu dari arah samping.
Selain nauplius, di dasar wadah juga akan terkumpul kista yang tidak menetas. Aerasi tetap dimatikan selama 10 menit. Setelah semua cangkang berkumpul di atas permukaan air dan terpisah dengan nauplius yang berada di dasar wadah maka pemanenan dapat dilakukan dengan cara membuka kran pada dasar wadah (jika ada) atau dengan cara menyipon dasar. Sebelum kran dibuka atau disipon, ujung kran atau selang kecil dibungkus saringan yang berukuran 125 mikron dan dibawah saringan disimpan wadah agar nauplius Artemia tetap berada dalam media air. Setelah semua nauplius terpanen, kran ditutup atau penyiponan dihentikan. Pada saat pemanenan hindarilah terbawanya cangkang. Artemia yang tersaring kemudian dibilas dengan air laut bersih dan siap diberikan ke larva ikan atau udang. Selanjutnya air dan cangkang yang tersisa di wadah penetasan dibuang dan dibersihkan.
SUMBER:
Jusadi D., 2003. Modul Penetasan Artemia - Budidaya Pakan Alami Air Tawar. Direktorat Pendidikan Menengah Kejuruan, Direktorat Jenderal Pendidikan Dasar dan Menengah, Jakarta.
Lavens, P. And P. Sorgeloos. 1996. Manual on the production and used of live food for aquaculture. FAO Fisheries Technical Paper 361.
MENGENAL DAPHNIA (PAKAN ALAMI)
Daphnia sp. Adalah jenis zooplankton yg hayati di air tawar, mendiami kolam-kolam atau danau-danau. Daphnia sp. Bisa hayati di wilayah tropis & subtropis. Kehidupan Daphnia sp. Dipengaruhi sang beberapa faktor ekologi perairan diantaranya: suhu, oksigen terlarut & pH. Daphnia sp. Bisa menyesuaikan diri dengan baik pada perubahan lingkungan hidupnya dan termasuk pada ketegori hewan eutitropik & tahan terhadap fluktuasi suhu harian atau tahunan. Kisaran suhu yg bisa ditolerir bervariasi sesuai adaptasinya dalam lingkungan tertentu.
Gambar 1. Daphnia
Daphnia sp. Dapat hidup pada air yang kandungan oksigen terlarutnya sangat bervariasi yaitu dari hampir nol hingga lewat jenuh. Ketahanan Daphnia sp. Dalam perairan yang miskin oksigen mungkin disebabkan sang kemampuannya dalam mensintesis haemoglobin. Dalam kenyataannya, laju pembentukan haemoglobin herbi kandungan oksigen lingkungannya. Naiknya kandungan haemoglobin dalam darah Daphnia sp. Dapat jua diakibatkan oleh naiknya temperatur, atau tingginya kepadatan populasi. Untuk bisa hayati dengan baik Daphnia sp. Memerlukan oksigen terlarut yang relatif akbar yaitu pada atas tiga,5 ppm.
Daphnia sp. Hidup dalam kisaran pH relatif besar , namun nilai Ph yang optimal buat kehidupannya sukar dipengaruhi. Lingkungan perairan yang netral & relatif basah yaitu pada pH 7,1 ? 8,0 baik buat pertumbuhannya. Pada kandungan amoniak antara 0,35 ? 0,61 ppm, Daphnia sp. Masih dapat hayati dan berkembangbiak dengan baik.
Di alam genus Daphnia mencapai lebih menurut 20 spesies & hayati dalam berbagai jenis perairan tawar, terutama di wilayah sub tropis. Daphnia sp. Sebagai fauna air, jua dikenal menjadi kutu air (= water fleas). Daphnia sp. Dapat diklasifikasikan dalam:
Philum : Arthropoda
Kelas : Crustacea
Sub Klas : Branchiopoda
Divisi : Oligobranchiopoda
Ordo : Cladocera
Famili : Daphnidae
Genus : Daphnia
Spesies : Daphnia sp.
Bentuk tubuh Daphnia sp. Oval & segmen badan tidak terlihat. Pada bagian ventral kepala terdapat paruh. Kepala mempunyai 5 pasang apendik, yg pertama dianggap antenna pertama, ke 2 diklaim antenna kedua yg memiliki fungsi utama sebagai alat gerak. Tiga pasang yang terakhir merupakan bagian-bagian menurut mulut.
Tubuh ditutupi oleh cangkang menurut kutikula yang mengandung khitin yg transparan, di bagian dorsal bersatu, namun dibagian ventral terbuka & terdapat lima pasang kaki.
Ruang antara cangkang dan tubuh bagian dorsal merupakan tempat pengeraman telur. Pada ujung post abdomen terdapat dua kuku yang berduri kecil-kecil. Pada habitat aslinya, Daphnia sp. berkembangbiak secara parthenogenesis. Perbandingan jenis kelamin atau “sex ratio” pada Daphnidae menunjukkan keragaman dan tergantung pada kondisi lingkungannya. Pada lingkungan yang baik, hanya terbentuk individu betina tanpa individu jantan. Pada kondisi ini, telur dierami di dalam kantong pengeraman hingga menetas dan anak Daphnia sp. dikeluarkan pada waktu pergantian kulit. Didalam kondisi yang mulai memburuk, disamping individu betina dihasilkan individu jantan yang dapat mendominasi populasi dengan perbandingan 1 : 27. Dengan munculnya individu jantan, populasi yang bereproduksi secara seksual akan membentuk efipia atau “resting egg” disebut juga siste yang akan menetas jika kondisi perairan baik kembali. Terbentuknya telur-telur yang menghasilkan individu jantan dirangsang oleh : (a) Melimpahnya individu betina yang mengakibatkan akumulasi hasil ekspresi; (b) Berkurangnya makanan yang tersedia; (c) Menurunnya suhu air dari 25-30 menjadi 14-170C.
Kondisi-syarat tersebut bisa mengubah metabolisme Daphnia sp. Sebagai akibatnya bisa menghipnotis prosedur kromosomnya. Di daerah tropis, Daphnia sp. Yg didatangkan menurut wilayah subtropis tak jarang jua membentuk efipia dalam trend kemarau.
Daphnia sp. Dewasa ukuran 2,5 mm anak pertama sebesar 0,8 mm dihasilkan secara parthenogenesis. Daphnia sp. Mulai membentuk anak pertama kali dalam umur 4-6 hari. Pada lingkungan yang bersuhu antara 22 ? 310C pH antara 6,6 ? 7,4 Daphnia sp. Sudah sebagai dewasa dalam saat empat hari menggunakan umur yang dapat dicapai hanya 12 hari.
Setiap satu atau 2 hari sekali, Daphnia sp. Akan beranak 29 ekor. Jadi selama hidupnya hanya bisa beranak tujuh kali dengan jumlah yang didapatkan 200 ekor.
Selama hidupnya Daphnia sp. Mengalami empat periode yaitu telur, anak, remaja & dewasa. Pertambahan ukuran terjadi sesaat selesainya telur menetas didalam ruang pengeraman. Setelah 2 kali instar pertama, anak Daphnia sp. Yg bentuknya seperti Daphnia sp. Dewasa dilepas berdasarkan ruang pengeraman. Jumlah instar dalam stadium anak ini hanya 2 hingga lima kali, tetapi tingkat pertumbuhan tertinggi terjadi dalam stadium ini.
Periode remaja merupakan instar tunggal antara instar anak terakhir & instar dewasa pertama. Pada periode ini sekelompok telur pertama mencapai perkembangan penuh di pada ovarium. Segera sehabis Daphnia sp. Ganti kulit pada akhir instar remaja memasuki instar dewasa pertama, sekelompok telur pertama dilepaskan ke ruang pengeraman.
Selama instar dewasa pertama, grup telur ke 2 berkembang di ovarium dan seterusnya. Tetapi adakalanya masih ada periode steril dalam Daphnia sp. Tua.
Pertambahan panjang dan bobot Daphnia sp. Selama pertumbuhan relatif pesat, terutama sesudah ganti kulit. Selama instar anak terjad pertumbuhan hampir dua kali lipat dibandingkan sebelum ganti kulit. Sedangkan pertambahan volume terjadi dalam beberapa dtk atau mnt sebelum eksoskeleton baru mengeras & kehilangan elastisitasnya.
Pada akhir setiap instar Daphnia sp. Dewasa masih ada peristiwa berurutan yang berlangsung cepat, umumnya terjadi pada beberapa mnt sampai beberapa jam, yaitu: (1) Lepasnya atau keluarnya anak menurut ruang pengeraman; (2) Ganti kulit (molting); (tiga) Pertambahan ukuran; dan (4) Lepasnya sekelompok telur baru ke ruang pengeraman.
SUMBER:
Mokoginta I., 2003. Modul Budidaya Daphnia - Budidaya Pakan Alami Air Tawar. Direktorat Pendidikan Menengah Kejuruan, Direktorat Jenderal Pendidikan Dasar dan Menengah, Jakarta.
REFERENSI:
Delbare, D. And Dhert, P. 1996. Cladoecerans, Nematodes and Trocophara Larvae, p. 283 ? 295. In Manual on The Production and Use of Live Food (P. Lavens and P. Sorgelos, eds). FAO Fisheries Technical Paper 361.
Sulasingkin, D. 2003. Pengaruh konsentrasi ragi yang tidak sinkron terhadap pertumbuhan populasi Daphnia sp. Skripsi. FPIK. IPB.
PENGINOKULASIAN BIBIT DAN PEMANENAN PADA BUDIDAYA CHLORELLA (PAKAN ALAMI)
PENGINOKULASIAN
Pada prinsipnya cara penginokulasian jenis–jenis fitoplankton adalah sama. Fitoplankton yang umum dibudidaya di panti benih ikan air tawar adalah Chlorella. Fitoplankton ini diperlukan sebagai pakan zooplankton, seperti rotifera misalnya.
Di dalam media pemeliharaan larva ikan, Chlorella biasa ditambahkan untuk mempertahankan kualitas air, mengontrol kelimpahan mikroba, serta mempertahankan nilai nutrisi dari zooplankton yang ada di dalamnya.
Chlorella adalah fitoplankton yang bersel tunggal dengan ukuran sel 5 mm. Chlrorella adalah fitoplankton yang berwarna hijau sebab mengandung khlorofil. Identifikasi Chlorella dapat dilakukan dengan menggunakan mikroskop.

Gambar 1. Chlorella sp.
Bibit fitoplankton dapat diperoleh menurut Lembaga Penelitian milik pemerintah. Volume inokulan (bibit fitoplankton) umumnya sebesar 2- 10% dari volume bak yg akan dipakai. Dalam saat lima?7 hari akan dicapai zenit populasi menggunakan kepadatan 107 sel/mililiter media. Secara fisik akan terlihat bahwa air akan berwarna hijau apabila budidayanya berhasil. Air media yg berwarna coklat menerangkan adanya fitoplankton yg mati atau terjadi kontaminasi dengan fitoplankton lain yg berwarna coklat.
Bibit yang didapat pada umumnya hanya sedikit, oleh karena itu tidak dapat langsung dibudidayakan dalam skala masal. Bibit yang didapat dari Panti Benih atau Lembaga Pemerintah sebaiknya disimpan di dalam ruangan tertutup dan dikultur dengan menggunakan larutan Walne. Setiap 10-14 hari sekali dilakukan pemindahan ke media yang baru. Selanjutnya untuk membudidayakan cholrella secara massal di lakukan upscalling yaitu peningkatan skala secara bertahap.
PEMANENAN
Chlorella umumnya langsung digunakan dengan media budidayanya setelah populasi Chlorella mencapai puncaknya. Hasil panen tersebut dapat langsung digunakan sebagai makanan rotifera atau ditambahkan ke dalam media budidaya larva ikan.
Chlorella beserta media budidayanya dapat dipindahkan ke bak pemeliharaan larva atau rotifera dengan cara mengalirkan media melalui selang dengan cara perbedaan tinggi. Cara ini adalah yang paling sederhana. Untuk mengurangi kotoran yang dapat terbawa bersama fitoplankton maka pada ujung selang dapat digunakan plankton net dengan lubang mata jaring 50–70 mm.
Pemanenan dapat dilakukan sekaligus untuk seluruh volume atau hanya 50% volume. Lima puluh persen volume yang tertinggal berguna sebagai inokulan Chlorella Bak diisi air kembali dan dipupuk dengan dosis dan macam pupuk yang sama pada awal budidaya. Chlorella dapat dipanen kembali setelah 5-7 hari. Pada budidaya Chlorella yang berkesinambungan ini biasanya hanya dapat berlangsung 3 kali panen.
Setelah 3 kali panen, biasanya budidaya Chlorella sudah terkontaminasi dengan phytoplankton atau mikroorganisme lain, sehingga harus dimulai lagi dari awal, artinya harus dimulai dari kegiatan belajar 1 kembali.
Cara lain pemanenan adalah dengan menggunakan pompa air. Media beserta Chlorella dapat dipindahkan ke bak lain dengan menggunakan pompa air.
Pemanenan Chlorella: Setelah mencapai puncak populasi, Chlorella dipanen dengan memindahkan alga berikut airnya dengan menggunakan selang. Untuk mengalirkan Chlorella, bak kultur rotifera ditempatkan lebih rendah dari bak Chlorella atau digunakan pompa listrik.
SUMBER:
Jusadi D., 2003. Modul Budidaya Rotifera - Budidaya Pakan Alami Air Tawar. Direktorat Pendidikan Menengah Kejuruan, Direktorat Jenderal Pendidikan Dasar dan Menengah, Jakarta.
Coutteau, P. 1996. Micro?Algae, p. 7?48. In P. Lavens and P. Sorgeloos (eds) Manual on the production and used of live food for aquaculture. FAO Fisheries Technical Paper 361..
MEMAHAMI KONSEP DASAR EKOLOGI

Ekologi adalahilmu yang mempelajariinteraksi antaraorganisme denganlingkungannya dan yang lainnya. Berasal dari kataYunani oikos ("habitat") dan logos ("ilmu"). Ekologi diartikan sebagai ilmu yang mempelajari baik interaksi antar makhluk hidup maupun interaksi antara makhluk hidup dan lingkungannya. Istilah ekologi pertama kali dikemukakan olehErnst Haeckel (1834-1914).[1] Dalam ekologi, makhluk hidup dipelajari sebagai kesatuan atau sistem dengan lingkungannya.
Pembahasan ekologi tidak lepas dari pembahasanekosistem dengan berbagai komponen penyusunnya, yaitu faktorabiotikdanbiotik. Faktor abiotik antara lainsuhu, air, kelembaban,cahaya, dan topografi, sedangkan faktor biotik adalah makhluk hidup yang terdiri dari manusia, hewan, tumbuhan, dan mikroba. Ekologi juga berhubungan erat dengan tingkatan-tingkatan organisasi makhluk hidup, yaitu populasi, komunitas, dan ekosistem yang saling memengaruhi dan merupakan suatu sistem yang menunjukkan kesatuan.
Ekologi merupakan cabang ilmu yang masih relatif baru, yang baru muncul pada tahun 70-an.[2] Akan tetapi,ekologimempunyai pengaruh yang besar terhadap cabang biologinya. Ekologi mempelajari bagaimanamakhluk hidup dapat mempertahankan kehidupannya dengan mengadakan hubungan antar makhluk hidup dan dengan benda tak hidup di dalam tempat hidupnya atau lingkungannya.[2] Ekologi,biologi dan ilmu kehidupan lainnya saling melengkapi denganzoologi danbotaniyang menggambarkan hal bahwa ekologi mencoba memperkirakan, dan ekonomi energi yang menggambarkan kebanyakanrantai makananmanusia dan tingkat tropik.
Para pakar ekologi mengusut hal berikut:
- Perpindahanenergi danmateri dari makhluk hidup yang satu ke makhluk hidup yang lain ke dalam lingkungannya dan faktor-faktor yang menyebabkannya.
- Perubahanpopulasi atau spesies pada waktu yang berbeda dalam faktor-faktor yang menyebabkannya.
- Terjadi hubungan antarspesies (interaksi antarspesies) makhluk hidup dan hubungan antara makhluk hidup dengan lingkungannya.
- Kini paraekolog (orang yang mempelajari ekologi)berfokus kepada Ekowilayahbumi dan riset perubahan iklim.
Dalam Wikipedia bahasa Indonesia (http://id.wikipedia.org/) dijelaskan bahwa: Komunitas adalah sebuah kelompoksosial dari beberapaorganisme yang berbagi lingkungan, umumnya memiliki ketertarikan dan habitat yang sama. Amrida, 2012 (dalam http://amrida-akkas.blogspot.com) mencoba memaparkan beberapa pengertian komunitas menurut para pakar, antara lain:
- Komunitas adalah kumpulan populasi tumbuhan dan tanaman yang hidup secara bersama di dalam suatu lingkungan.
- Komunitas adalah seluruh populasi mahluk hidup yang hidup di suatu daerah tertentu.
- Komunitas merupakan komponen biotik dalam suatu ekosistem.
Sehingga secara umum Komunitas dapat diartikan menjadi deretan dari beberapa populasi makhluk hayati, yang memiliki ketertarikan & interaksi & hayati dalam suatu daerah tertentu.
1. Perbedaan antara komunitas dan populasi dapat dilihat pada tabel dibawah ini.
Tabel 1. Perbedaan komunitas dan populasi
NO. | URAIAN | PERBEDAAN | |
KOMUNITAS | POPULASI | ||
1. | Kedudukannya dalam ekosistem | kumpulan dari berbagai populasi | kumpulan dari organisme yang sama |
2. | Batasan organisme yang menempati suatu daerah tertentu | seluruh populasi mahluk hidup | kumpulan individu sejenis |
3. | Parameter pengukuran | Pengukuran bersifat komplek, meliputi seluruh makhluk hidup pada suatu daerah tertentu | Memiliki sifat dan cirri yang dapat diukur, diantaranya: (1) kepadatan populasi; (2) natalitas; (3) mortalitas; (4) distribusi penyebaran umur; (5) pertumbuhan/perkembangan; dan (6) disperse. |
Contoh komunitas:
a. Komunitas lahan rawa gambut di Kabupaten Hulu Sungai Utara;
b. Komunitas sungai barito di Kalimantan Selatan.
Contoh populasi:
a. Populasi Itik Alabio pada lahan rawa gambut di Kabupaten Hulu Sungai Utara;
b. Populasi Ikan Tapah pada Sungai Barito di Kalimantan Selatan.
Sumber:
http://id.Wikipedia.Org/wiki/Ekologi
http://www.Google.Com/imgres?
PENYIAPAN WADAH DAN MEDIA PADA BUDIDAYA DAPHNIA (PAKAN ALAMI)
Daphnia merupakan salah satu pakan alami yang penting dalam kegiatan pembenihan ikan konsumsi dan ikan hias air tawar. Dalam Modul Budidaya Daphnia akan dipelajari tentang identifikasi Daphnia, bagaimana menyiapkan wadah dan media untuk budidaya Daphnia, bagaimana cara memelihara Daphnia, seperti identifikasi dan inokulasi, pemupukan dan pemberian pakan serta pemanenan.
Gambar 1. Daphnia
Wadah dan volume yang dapat digunakan untuk membudidayakan Daphnia ada beberapa macam antara lain adalah: bak semen, bak fiber, kolam atau akuarium. Pemilihan wadah budidaya ini sangat bergantung kepada skala produksi budidaya Daphnia. Wadah budidaya Daphnia ini sebaiknya ditempatkan di ruang terbuka.
Daphnia adalah jenis zooplankton yang hidup di air tawar yang mendiami kolam-kolam, sawah dan perairan umum (danau) yang banyak mengandung bahan organik. Sebagai organisme air, Daphnia dapat hidup di perairan yang berkualitas baik. Beberapa faktor ekologi perairan yang berpengaruh terhadap perkembangbiakan Daphnia antara lain adalah kesadahan, suhu, oksigen terlarut dan pH.
Cara membudidayakan Daphnia dapat dilakukan dengan melakukan pemupukan pada wadah budidaya. Hal ini bertujuan untuk menumbuhkan phytoplankton di dalam wadah budidaya yang digunakan oleh Daphnia sebagai makanannya agar tumbuh dan berkembangbiak.
Pada budidaya Daphnia di kolam pupuk yang digunakan berupa kotoran ayam (kering) dengan dosis 1 kg/m2. Selain kotoran ayam, pemupukan dapat dilakukan dengan menggunakan kotoran burung puyuh. Dalam membudidayakan Daphnia sebaiknya wadah budidayanya diletakkan di ruang terbuka yang mendapat sinar matahari yang cukup dan sangat dibutuhkan untuk proses fotosintesa phytoplankton.
Kedalaman air pada wadah budidaya Daphnia sebaiknya lebih dari 60 cm, agar Daphnia bisa terhindar dari intensitas cahaya matahari yang tinggi pada siang hari. Biasanya pada siang hari Daphnia akan berenang ke dasar wadah untuk menghindari intensitas cahaya dan suhu yang tinggi.
sebaliknya tingginya intensitas cahaya matahari akan merangsang phytoplankton untuk tumbuh cepat. Untuk menghindari meluapnya air pada saat hujan, sebaiknya wadah budidaya Daphnia diberi naungan dengan atap yang terbuat dari plastik/fiber yang transparan.
Daphnia merupakan salah satu hewan yang sangat sensitive terhadap kontaminasi bahan kimia. Sebagai contoh apabila wadah budidayanya baru dibuat maka wadah tersebut harus direndam/dibilas dengan air sampai wadah tersebut tidak berbau. Untuk budidaya Daphnia, air yang digunakan sebaiknya memiliki kesadahan 250 mg/liter CO3 dan pH air dipertahankan sekitar 7 – 8 dengan cara dilakukan pengapuran di dalam wadah budidaya dengan kapur pertanian. Selain itu sebaiknya di dalam wadah budidaya Daphnia juga diberi aerator yang berfungsi untuk menghasilkan oksigen di dalam wadah budidaya agar nilai oksigen terlarut di wadah tersebut diatas 3,5 ppm dan kadar ammonia kurang dari 0,2 mg/liter.
Gambar dua. Wadah budidaya Daphnia
Dari beberapa parameter kualitas air yang telah diuraikan sebelumnya dapat diketahui bahwa Daphnia memerlukan kualitas air yang prima untuk media hidupnya. Sama halnya dengan ikan, oksigen sangat diperlukan oleh Daphnia untuk mendukung kehidupannya, sedangkan amonia bersifat racun yang dapat mengakibatkan kematian.
Untuk mempertahankan kondisi air selama masa budidaya agar tetap prima, maka air harus diaerasi secara kontinyu serta dilakukan pergantian air. Pergantian air pada media budidaya Daphnia dapat dilakukan dengan cara penyiponan, yaitu air didalam wadah budidaya dibuang dengan cara menggunakan selang. Pergantian air ini sangat bergantung kepada kebutuhan Daphnia di dalam media budidaya.
SUMBER:
Mokoginta I., 2003. Modul Budidaya Daphnia - Budidaya Pakan Alami Air Tawar. Direktorat Pendidikan Menengah Kejuruan, Direktorat Jenderal Pendidikan Dasar dan Menengah, Jakarta.
REFERENSI:
Delbare, D. And Dhert, P. 1996. Cladoecerans, Nematodes and Trocophara Larvae, p. 283 ? 295. In Manual on The Production and Use of Live Food (P. Lavens and P. Sorgelos, eds). FAO Fisheries Technical Paper 361.
Sulasingkin, D. 2003. Pengaruh konsentrasi ragi yang tidak sinkron terhadap pertumbuhan populasi Daphnia sp. Skripsi. FPIK. IPB
INOKULASI, PEMELIHARAAN DAN PEMANENAN PADA BUDIDAYA DAPHNIA (PAKAN ALAMI)

Inokulasi Daphnia dapat dilakukan dengan memakai siste maupun induk Daphnia (Daphnia dewasa). Padat tebar Daphnia awal pada umumnya antara 20–100 individu perliter media. Inokulan bisa diperoleh dari hasil budidaya di petani, Balai Benih Air Tawar, Balai Budidaya ataupun Lembaga Penelitian serta di perairan. Keberadaan Daphnia di perairan dapat dilihat dengan mata telanjang. Oleh karena itu untuk menghitung kepadatan Daphnia pada saat inokulasi maupun masa budidaya, dapat dilakukan tanpa menggunakan alat pembesar atau mikroskop. Daphnia diambil dari dalam wadah, yang telah diaerasi agak besar sehingga Daphnia merata berada di seluruh kolom air, dengan memakai gelas piala volume 100 ml. Daphnia dan air di dalam gelas piala selanjutnya dituangkan secara perlahan-lahan sambil dihitung jumlah Daphnia yang keluar bersama air.
Apabila jumlah Daphnia yang ada sangat banyak, maka dari gelas piala 100 ml dapat diencerkan, caranya adalah dengan menuangkan ke dalam gelas piala 1000 ml dan ditambah air hingga volumenya 1000 ml.
Dari gelas 1000 ml, lalu diambil sebanyak 100 ml. Daphnia yang ada dihitung seperti cara diatas, lalu kepadatan di dalam wadah budidaya dapat diketahui dengan cara mengalikan 10 kali jumlah di dalam gelas 100 ml. Sebagai contoh, apabila di dalam gelas piala 100 ml terdapat 200 ekor Daphnia, maka kepadatan Daphnia di wadah budidaya adalah 10 X 200 ekor = 2000 individu per 100 ml.
Daphnia yang dibudidayakan bisa juga berasal dari perairan umum atau kolam, dan biasanya terbawa dalam aliran air dalam bentuk siste atau induk dewasa. Oleh karena itu dalam proses budidaya Daphnia dilakukan pemupukan di dalam wadah budidaya yang bertujuan untuk menumbuhkan phytoplankton. Kepadatan phytoplankton yang dibutuhkan untuk budidaya Daphnia adalah 105 - 106 sel/ml media budidaya. Pemupukan wadah budidaya ini dilakukan dengan cara mencampur 2,4 gram kotoran ayam dalam 1 liter air media budidaya.
Daphnia memakan berbagai macam bakteri, ragi, alga berseltunggal, dan detritus. Bakteri dan fungi menduduki urutan teratas dari nilai nutrisi baginya. Sedangkan makanan utama bagi Daphnia adalah alga dan protozoa. Daphnia mengambil makanannya dengan cara menyaring makanan atau “filter feeding”. Gerakan yang kompleks dari kaki-kaki toraks menghasilkan arus air yang konstan. Gerakan kaki-kaki tersebut berperan penting dalam proses pengambilan makanan.
Pasangan kaki ketiga dan ke empat dipakai untuk menyaring makanan, sedang kaki pertama dan kedua digunakan untuk menimbulkan arus air sehingga partikel-partikel tersuspensi bergerak ke arah mulut. Partikelpartikel makanan yang tertahan kemudian tersaring oleh setae, selanjutnya digerakan ke bagian mulut dan ditelan oleh Daphnia.
Daphnia muda berukuran panjang kurang dari 1 mm menyaring partikel berukuran kecil sampai dengan 20 – 30 mikron, sedangkan yang dewasa dengan ukuran panjang 2 – 3 mm dapat menangkap partikel sebesar 60 – 140 mikron.
Dalam kondisi makanan yang normal, penyaringan dan pemasukan makanan ke saluran pencernaan terjadi terus tanpa irama yang pasti. Penyaringan dan pemakanan partikel tersuspensi merupakan peristiwa mekanik tanpa seleksi aktif untuk makanan yang paling baik. Dengan kondisi pemeliharaan yang baik populasi Daphnia dapat mencapai 800-1000 ind/l.
Oleh karena itu dalam memelihara Daphnia agar tumbuh dan berkembang harus dilakukan pemupukan susulan yang bertujuan untuk menumbuhkan phytoplankton, bakteri dan organisme bersel satu lainnya.
Tetapi harus juga diingat dalam pemupukan susulan jumlah pupuk yang diberikan jangan berlebihan karena hal tersebut dapat mengakibatkan terjadinya blooming phytoplankton. Hal tersebut dapat mengakibatkan kadar amonia yang tinggi dan oksigen terlarut yang sangat rendah dalam wadah budidaya yang dapat mengakibatkan kematian Daphnia.
Pemanenan Daphnia sp. dapat dilakukan pada hari ke 7-8. Umumnya puncak populasi Daphnia sp (400 – 1.000 ind/l) dapat dicapai pada hari ke 8-10 setelah dilakukan inokulasi bibit Daphnia sp.
Pemanenan dapat dilakukan dengan dua cara. Cara pertama adalah dengan memanen seluruh Daphnia sp. yang ada dalam wadah/bak. Cara ini praktis, tetapi untuk mendapatkan hasil Daphnia sp. secara terus menerus sering gagal, dan setiap kali Daphnia sp. dipanen, budidaya Daphnia sp. harus diulang kembali dari awal. Cara ke dua adalah dengan memanen sebagian Daphnia sp. Pemanenan dapat dilakukan sebanyak 50% volume wadah/bak, dan maksimum 70%. Sisa volume 30-50% dipindahkan ke wadah/bak yang sudah disanitasi dan diisi air 50 –70% yang telah dipupuk selama 12 hari sebelumnya. Daphnia sp yang terdapat pada volume media 30-50% berperan sebagai bibit/inokulan Daphnia sp pada budidaya selanjutnya.
Pada hari ke 4-5 pemanenan ke dua sudah dapat dilakukan. Untuk mendapatkan panen ke tiga maka kegiatan pemanenan pertama diulang kembali seperti urutan di atas. Cara ini sangat baik untuk mendapatkan hasil panen Daphnia secara berkesinambungan. Daphnia dewasa berukuran besar 1,0 – 1,2 mm, sedangkan yang muda berukuran sedang 0,5 – 1,0 mm. Untuk keperluan larva ikan, umumnya digunakan Daphnia sp berukuran di atas 0,5 mm, oleh sebab itu untuk keperluan pemanenan digunakan saringan dengan lubang mata jaring 0,5 mm.
Pemanenan umumnya dilakukan menggunakan mengalirkan air melalui selang yg dalam ujung yang satu diberi saringan. Ujung selang yang diberi saringan usahakan terendam dalam bak mini atau ember dan airnya permanen diaerasi.
Hasil panen Daphnia sp ini dapat langsung diberikan ke larva ikan atau dapat dimasukkan ke kantong plastik obat dan disimpan di freezer. Daphnia sp yang beku ini dapat digunakan kembali untuk larva ikan.
SUMBER:
Mokoginta I., 2003. Modul Budidaya Daphnia - Budidaya Pakan Alami Air Tawar. Direktorat Pendidikan Menengah Kejuruan, Direktorat Jenderal Pendidikan Dasar dan Menengah, Jakarta.
REFERENSI:
Delbare, D. And Dhert, P. 1996. Cladoecerans, Nematodes and Trocophara Larvae, p. 283 ? 295. In Manual on The Production and Use of Live Food (P. Lavens and P. Sorgelos, eds). FAO Fisheries Technical Paper 361.
Sulasingkin, D. 2003. Pengaruh konsentrasi ragi yang berbeda terhadap pertumbuhan populasi Daphnia sp. Skripsi. FPIK. IPB.
IDENTIFIKASI DAN PEMILIHAN BAHAN BAKU PAKAN BUATAN Bagian 1: Bahan Baku Nabati
Dalam menciptakan pakan protesis buat ikan, hal pertama yang wajib dipertimbangkan, merupakan persyaratan bahan baku buat pakan, yaitu :
1. Bahan baku pakan tidak boleh bersaing dengan bahan makanan manusia. Bila manusia banyak membutuhkannya, bahan baku ini tidak boleh diberikan kepada ikan.
2. Bahan baku ini harus tersedia dalam waktu lama, atau ketersediaannya harus kontinyu. Bahan baku yang pada suatu saat ada dan kemudian lenyap, harus dihindari. Padi yang diproduksi secara massal dan nasional, tentu menyebabkan ketersediaan dedak dan bekatul untuk ternak juga melimpah ruah. Sebaliknya untuk bahan baku yang diproduksi secara terbatas, juga akan menghasilkan bahan secara terbatas pula.
3. Harga bahan baku; walaupun bisa digunakan, tapi bila harganya mahal maka penggunaan bahan atau peran bahan baku itu sebagai bahan baku sudah tersisihkan. Sebenarnya murah atau mahalnya bahan baku itu harus dinilai dari manfaat bahan itu, yang merupakan cermin dari kualitas bahan tersebut. Tepung ikan, misalnya harganya memang mahal, tetapi bila dibandingkan dengan kandungan proteinnya yang tinggi dan kelengkapan asam aminonya, maka penggunaan tepung ikan menjadi murah.
4. Kualitas gizi bahan baku, menjadi persyaratan penting lainnya. Walaupun harganya murah, banyak terdapat di Indonesia, dan ketersediaannya kontinyu, tetapi bila kandungan gizinya buruk, tentu bahan baku ini tidak dapat digunakan.
Khusus buat ikan, pakan buatan yg diberikan bisa dikatagorikan sebagai :
1. Pakan alami, merupakan kelompok pakan yang berasal dari hewan yang berukuran renik sampai ukuran beberapa centimeter yang di kultur atau dikumpulkan dari alam; contohnya adalah Artemia, Daphnis dan Cacing Sutra. Pakan alami ini dapat juga berasal dari tumbuhan, misalnya fitoplankton dan daun talas.
2. Pakan lembek, merupakan cincangan ikan-ikan rucah dan cumi-cumi yang langsung diberikan kepada ikan. Daya tahan pakan lembek ini 2 – 3 hari dalam lemari pendingin.
3. Pakan kering lengkap, merupakan pakan berbentuk pelet, “flake” dan “crumble” dengan kadar air rendah sehingga daya tahannya bisa 3 – 4 bulan dan kandungan gizinya cukup lengkap karena dibuat sesuai dengan kebutuhan. Jenis pakan inilah yang akan dikupas lebih mendalam.
Dalam leaflet ini, bahan standar akan dibagi sebagai dua kelompok, yaitu bahan standar nabati dan bahan standar hewani. Banyak sekali bahan standar nabati yg bisa diberikan kepada unggas, bahan standar nabati inilah, yang menyebabkan harga pakan menjadi dapat ditekan. Dari sekian poly bahan standar nabati, 70 ? 75% merupakan biji-bijian dan hasil olahannya, 15 ? 25% limbah industri makanan, & sisanya hijauan sebagaimana layaknya bahan pakan yg berasal berdasarkan biji-bijian, bahan pakan botani ini sebagian akbar adalah asal tenaga yg baik, namun lantaran asalnya berdasarkan tumbuhan, kadar serat kasarnya tinggi.
Sebagai sumber vitamin, beberapa bahan berbentuk bijian atau olahannya tidaklah mengecewakan.
BAHAN BAKU NABATI
1. Jagung kuning
Selain jagung kuning, masih ada 2 warna lagi, pada jagung (Zea mays), yaitu jagung putih dan jagung merah. Diantara ketiga warna itu, jagung merah & jagung putih jarang terlihat pada Indonesia. Jagung kuning merupakan bahan baku ternah & ikan yang popular digunakan di Indonesia & pada beberapa negara. Jagung kuning digunakan sebagai bahan baku pembuat energi, tetapi bukan menjadi bahan asal protein, lantaran kadar protein yg rendah (8,9%), seperti yang terlihat dalam tabel 1, bahkan defisien terhadap asam amino krusial, terutama lysin & triptofan.
Tabel 1 : Komposisi Jagung
Sebagai asal energi yang rendah serat kasarnya, asal Xantophyll, & asam lemak yg baik, jagung kuning nir diragukan lagi. Asam linoleat jagung kuning sebanyak 1,6%, tertinggi diantara gerombolan biji-bijian.
2. Dedak halus
Dedak adalah limbah proses pengolahan gabah, & nir dikonsumsi insan, sebagai akibatnya tidak bersaing dalam penggunaannya. Dedak mengandung bagian luar beras yang nir terbawa, tetapi tercampur pula dengan bagian epilog beras itu. Hal ini menghipnotis tinggi-rendahnya kandungan serat kasar dedak. Tabel dua berikut menyajikan kualitas nutrisi dedak halus.
Tabel dua : Kandungan Nutrisi Dedak
Kandungan serat kasar dedak 13,6%, atau 6 kali lebih akbar dari pada jagung kuning, merupakan pembatas, sehingga dedak nir dapat dipakai berlebihan. Kandungan asam amino dedak, walaupun lengkap tapi kuantitasnya tidak mencukupi kebutuhan ikan, demikian jua menggunakan vitamin dan mineralnya.
Tiga. Bungkil Kacang Kedelai
Selain sebagai bahan penghasil tempe dan memahami, kacang kedele mentah mengandung ?Penghambat trypsin? Yang wajib dihilangkan sang pemanasan atau metoda lain, sedangkan bungkil kacang kedelai, merupakan limbah berdasarkan proses pembuatan minyak kedelai.
Tabel tiga : Komposisi Gizi Bungkil Kedelai

4. Bungkil Kacang Tanah
Merupakan limbah dari pengolahan minyak kacang atau olahan lainnya. Kualitas bungkil kacang tanah ini tergantung pada proses pengolahan kacang tanah sebagai minyak. Disamping itu, proses pemanasan selama pengolahan berlangsung, pula memilih kualitas bungkil ini, selain dari kualitas tanah, pengolahan tanah dan varietas kacang itu sendiri.
Tabel 4 : Kandungan Nutrisi Bungkil Kacang Tanah
Kadar metionin, triptofan, treonin & lysin bungkil kacang tanah juga gampang terkotori sang jamur beracun Aspergillus flavus.
Lima. Minyak Nabati
Penggunaan minyak diharapkan pada pembuatan pakan ikan yg membutuhkan pasokan tenaga tinggi, yang hanya bisa diperoleh berdasarkan minyak. Minyak botani yang dipakai hendaknya minyak botani yang baik, tidak mudah tengik & tidak mudah rusak. Penggunaan minyak nabati yang umumnya dari berdasarkan kelapa atau sawit pada umumnya berkisar antara 2 ? 6 %.
6. Hijauan
Sebagai bahan campuran pakan, kini hijauan mulai diincar kembali, lantaran ternyata sampai batasan eksklusif hijauan menggunakan protein tinggi bisa mensubstitusi tepung ikan. Hijauan yang dimaksud antara lain azola, turi dan daun talas, yg apabila akan dipakai harus diolah terlebih dahulu, yakni pengeringan (panggang atau panas mentari ) tapi nir boleh Mengganggu warna, lalu penggilingan dan pengayakan.
SUMBER:
Masyamsir, 2001. Modul Membuat Pakan Ikan Buatan. Direktorat Pendidikan Menengah Kejuruan, Direktorat Jenderal Pendidikan Dasar dan Menengah, Jakarta.
REFERENSI:
Anggorodi, R., 1979. Ilmu Makanan Ternak Umum Gramedia, Jakarta, 1979
FAO, 1980, Fish Feed Technology. United Nations Development Programme, FAO United Nations, Rome, 395 P
Maynard, L.A., J.K. Loosli, H.F. Hintz, R.G. Warner, 1979, Animal Nutrition, Mc. Graw Hill., Inc. 602 P.
NRC, 1983, Nutrient Requirement of Warm Water Fishes & Shellfishes, National Academy Press, Washington DC. 102P
Rasyaf, M. 1990, Bahan Makanan Unggas di Indonesia Kanisius, Yogyakarta, 118 hal.
Rostika, R., 1997, Performan Juwanan Ikan mas yang dipengaruhi berbagai imbangan protein-energi pada pakan. Tesis Universitas Padjadjaran, tidak dipublikasikan, 145 hal.
Sumeru, S.U., dan Anna S., 1992, Pakan Udang Windu Kanisius, Yogyakarta, 94 hal.
PERSIAPAN WADAH DAN MEDIA PADA BUDIDAYA ARTEMIA (PAKAN ALAMI)
Artemia merupakan pakan alami yang sangat penting dalam pembenihan ikan laut, krustacea, ikan konsumsi air tawar dan ikan hias air tawar karena ukurannya yang sangat kecil. Disamping ukurannya yang kecil, nilai gizi Artemia juga sangat tinggi dan sesuai dengan kebutuhan gizi untuk larva ikan dan krustacea yang tumbuh dengan sangat cepat.
Gambar 1. Artemia
Sampai saat ini Artemia sebagai pakan alami belum dapat digantikan oleh pakan lainnya. Artemia biasanya diperjual belikan dalam bentuk kista/cyste, sehingga sebagai pakan alami Artemia merupakan pakan yang paling mudah dan praktis, karena hanya tinggal menetaskan kista saja. Akan tetapi, menetaskan kista Artemia bukan suatu hal yang dengan begitu saja dapat dilakukan oleh setiap orang. Sebab membutuhkan suatu keterampilan dan pengetahuan tentang penetasan itu sendiri. Kegagalan dalam menetaskan kista Artemia barakibat fatal terhadap larva ikan yang sedang dipelihara.
Penetasan Artemia dapat dilakukan, baik pada skala kecil maupun skala besar. Penetasan Artemia dapat pula dikerjakan di daratan maupun di daerah pantai.
Wadah penetasan Artemia dapat dilakukan dengan wadah kaca, poly etilen (ember plastik) atau fiber glass. Ukuran wadah dapat disesuaikan dengan kebutuhan, mulai dari volume 1 l sampai dengan volume 1 ton bahkan 40 ton. Hal yang penting untuk diperhatikan dalam penetasan Artemia adalah bentuk dari wadah. Bentuk wadah penetasan Artemia sebaiknya bulat. Hal ini dikarenakan jika diaerasi tidak ditemukan titik mati, yaitu suatu titik dimana Artemia akan mengendap dan tidak teraduk secara merata. Artemia yang tidak teraduk pada umumnya kurang baik derajat penetasannya, atau walaupun menetas membutuhkan waktu yang lebih lama.
Sebelum diisi media penetasan, wadah Artemia dicuci terlebih dahulu dengan menggunakan sikat sampai bersih. Agar sisa lemak atau lendir dapat dihilangkan, pada waktu mencuci gunakanlah deterjen. Media untuk penetasan Artemia dapat menggunakan air laut yang telah difilter. Hal ini ditujukan agar cyste dari jamur atau parasit tersaring.
Penyaringan dapat dilakukan dengan menggunakan filter pasir atau filter yang dijual secara komersial seperti catridge filter misalnya.
Disamping dengan air laut, media penetasan Artemia juga dapat dilakukan dengan menggunakan air laut buatan. Air laut ini dibuat dengan jalan menambahkan garam yang tidak beriodium ke air tawar. Garam yang digunakan harus bebas dari kotoran. Jumlah garam yang dibutuhkan berkisar antara 25-30 g per liter air tawar, sehingga memiliki kadar garam 25-30 ppt. Setelah garam dimasukkan maka media harus diaerasi secara kuat agar garam tercampur merata.
SUMBER:
Jusadi D., 2003. Modul Penetasan Artemia - Budidaya Pakan Alami Air Tawar. Direktorat Pendidikan Menengah Kejuruan, Direktorat Jenderal Pendidikan Dasar dan Menengah, Jakarta.
Lavens, P. And P. Sorgeloos. 1996. Manual on the production and used of live food for aquaculture. FAO Fisheries Technical Paper 361.
IDENTIFIKASI DAN PEMILIHAN BAHAN BAKU PAKAN BUATAN Bagian 2: Bahan Baku Hewani
BAHAN MAKANAN HEWANI
1. Tepung Ikan
Berasal dari ikan sisa atau buangan yg tidak dikonsumsi oleh insan, atau residu pengolahan industri kuliner ikan, sebagai akibatnya kandungan nutrisinya beragam, akan tetapi dalam umumnya berkisar antara 60 ? 70%. Tepung ikan adalah pemasok lysin & metionin yg baik, dimana hal ini tidak terdapat pada kebanyakan bahan baku botani.
Mineral kalsium dan fosfornya pun sangat tinggi, & lantaran berbagai keunggulan inilah maka harga tepung ikan menjadi mahal.
Tabel 1 : Kandungan Nutrisi Tepung Ikan

2. Tepung Darah
Merupakan limbah berdasarkan rumah potong fauna, yg banyak dipakai sang pabrik pakan, karena protein kasarnya tinggi. Walaupun demikian terdapat pembatas ?Religius? & ?Dampak kesehatan?. Baik buruknya tepung darah yg dipakai menjadi bahan standar menurut segi kesehatan, tergantung pada bagaimana bahan itu diperoleh berdasarkan rumah potong hewan. Bila berasal menurut penampungan yang bercampur kotoran, tentu bahan ini tidak layak dipakai, tapi jika berasal menurut penampungan yang bersih, maka tepung ini memenuhi syarat menjadi bahan standar pakan.
Tabel dua : Kandungan Nutrisi Tepung Darah
Kelemahan dari tepung darah merupakan miskin isoleucin dan rendah kalsium & fosfor, jua jika digunakan lebih dari lima% akan menimbulkan pengaruh ?Bau darah? Pada ikan.
Tiga. Sisa Potongan Rumah Jagal/Tepung Tulang
Berasal berdasarkan tulang-tulang dengan sedikit daging yang inheren, kemudian dikeringkan & digiling, pada pasaran biasa diklaim tepung tulang. Bahan ini dapat dipakai antara dua,lima ? 10% pada formula pakan & lebih bersifat menjadi pendamping tepung ikan. Bila digunakan berlebihan, tentu tidak menguntungkan, lantaran kalsium akan terlalu poly sebagai akibatnya menurunkan kesukaan makan.
4. Protein Sel Tunggal
Sebagai sumber protein, memang protein sel tunggal bisa dijadikan alternatif dari cara yg sudah ada. Kandungan proteinnya beragam sekali, mulai dari 30 ? 80%, tergantung berdasarkan bahan protein sel tunggalnya yaitu bakteri, jamur, ragi dan alga.
5. Tepung Bulu Terolah
Tepung bulu diperoleh menggunakan mengungkep bulu unggas pada wadah tertutup dengan tekanan tiga,2 atmosfer selama 45 mnt dan dikembalikan lagi dalam tekanan normal, sehabis itu dikeringkan dalam temperatur 60oC & digiling sampai halus. Tepung bulu mempunyai energi metabolis 2354 kal/kg dan asam amino tersedia sebesar 65% & penggunaannya maksimal 10%.
6. Limbah Unit Penetasan Ayam
Dalam penetasan telur ayam ras, terdapat telur-telur yang nir bertunas atau bertunas tapi mati, yg biasanya menjadi limbah. Limbah unit penetasan ini akan bermanfaat sekali buat makanan unggas dan ikan.
SUMBER:
Masyamsir, 2001. Modul Membuat Pakan Ikan Buatan. Direktorat Pendidikan Menengah Kejuruan, Direktorat Jenderal Pendidikan Dasar dan Menengah, Jakarta.
REFERENSI:
Anggorodi, R., 1979. Ilmu Makanan Ternak Umum Gramedia, Jakarta, 1979
FAO, 1980, Fish Feed Technology. United Nations Development Programme, FAO United Nations, Rome, 395 P
Maynard, L.A., J.K. Loosli, H.F. Hintz, R.G. Warner, 1979, Animal Nutrition, Mc. Graw Hill., Inc. 602 P.
NRC, 1983, Nutrient Requirement of Warm Water Fishes & Shellfishes, National Academy Press, Washington DC. 102P
Rasyaf, M. 1990, Bahan Makanan Unggas di Indonesia Kanisius, Yogyakarta, 118 hal.
Rostika, R., 1997, Performan Juwanan Ikan mas yang dipengaruhi berbagai imbangan protein-energi pada pakan. Tesis Universitas Padjadjaran, tidak dipublikasikan, 145 hal.
Sumeru, S.U., dan Anna S., 1992, Pakan Udang Windu Kanisius, Yogyakarta, 94 hal.
MEMAHAMI KONSEP ALIRAN ENERGI DALAM EKOSISTEM
Di alam semesta hanya masih ada satu asal tenaga yaitu cahaya surya. Di dalam modul pula dijelaskan bahwa sumber energi selain matahari seperti tenaga air, energi listrik, tenaga ombak & lain sebagainya itu seluruh merupakan hasil transformasi (aliran) energi mentari menjadi berbagai energi tersebut.
Anda juga masih ingat bahwa aliran tenaga energi di dalam ekosistem tidak sama menggunakan daur materi, dimana sifat energi mengikuti aturan-hukum termodinamika.
1. Hukum termodinamika I : yang menyatakan bahwa energi dapat diubah bentuknya, dari bentuk yang satu kebentuk yang lain, tetapi tidak dapat diciptakan maupun dimusnahkan.
2. Hukum termodinamika II : yang menyatakan bahwa setiap proses perubahan bentuk energi selalu tidak efesien. Oleh karena itu setiap perubahan bentuk energi, maka energi baru yang terbentuk konsentrasinya selalu lebih kecil dari pada konsentrasi energi sebelumnya.
Berapa besarkah energi yg mengalir dalam setiap organisme di pada ekosistem?
Marilah kita lihat gambar berikut:

Produser
Tanaman menjadi produser adalah awal menurut terjadinya aliran energi. Hanya kurang lebih 10% energi yang mengalir ke pada setiap aras trofik yang lebih tinggi
Konsumer utama
Hanya lebih kurang 10% tenaga yang tersedia dalam flora dapat digunakan sebagai kuliner bagi konsumer utama (herbivora).
Konsumer sekunder
Hanya kurang lebih 1% tenaga produser yang dapat dimanfaatkan sang konsumer sekunder.
Jadi hanya lebih kurang 10% dari setiap level/aras trofik yang bisa dimanfaatkan oleh organisme berikutnya. Begitu akbar entropi (tenaga yang tidak termanfaatkan) pada dalam suatu ekosistem.
Hukum Toleransi Shelford menyatakan bahwa buat setiap faktor lingkungan suatu janis organisme memiliki suatu kondisi minimum & maksimum yang mampu diterimanya, diantara kedua harga ekstrim tersebut merupakan kisaran toleransi dan didalamnya terdapat sebuah kondisi yang optimum. Dengan demikian setiap organisme hanya bisa hayati pada loka-tempat eksklusif saja, yaitu tempat yang cocok yg bisa diterimanya.
Diluar daerah tadi organisme nir dapat bertahan hayati dan dianggap daerah yg nir toleran (Sumber: https://plus.Google.Com/101867312495034004603/posts).
Hukum Shelford (Victor Shelford, 1913) mengemukakan pentingnya toleransi dalam menunjukkan distribusi berdasarkan jenis. Hukum toleransi menyatakan bahwa buat setiap factor lingkungan suatu jenis mempunyai suatu kondisi minimum dan maksimum yg dapat dipikulnya, diantara kedua harga ekstrim ini merupakan kisaran toleransi & termasuk suatu syarat optimum. Kisaran toleransi dapat dinyatakan dalam bentuk kurva lonceng, dan akan berbeda untuk setiap jenis terhadap faktor lingkungan yang sama atau mempunyai kurva yg berbeda buat satu jenis organisme terhadap factor-faktor lingkungan yang tidak sinkron. Misalnya jenis A mungkin mempunyai batas kisaran yang lebih luas terhadap suhu tetapi mempunyai kisaran yang sempat terhadap syarat tanah. Shelford menyatakan bahwa jenis-jenis menggunakan kisaran toleransi yg luas buat aneka macam faktor lingkungan akan menyebar secara luas.
Kandungan O2 di udara dalam jumlah banyak dan kontinu bukan merupakan faktor pembatas organisme darat. Sebaliknya, kandungan O2 terlarut di perairan, terdapat dalam jumlah sedikit & jumlahnya selalu berubah-ubah, sebagai faktor pembatas bagi organisme yang hayati pada perairan.
REFERENSI
Chiras, D. 1991. Environmental Science; Action For a Sustainable Future. The Benjamin/Cummings Publishing Company, Inc.
Http//ut.Ac.Id
Santoso, B, 2000. Baikuni dan Energi Alternatif, Kompas, 28 Juni 2000
Utomo, S.W. dan Rizal, R., 2006. Ekologi, Universitas Terbuka, Jakarta.
PERHITUNGAN FORMULASI BAHAN BAKU PAKAN BUATAN
Perjalanan tenaga dalam tubuh ikan, bisa dilihat pada gambar berikut:
Energi yg hilang berdasarkan tubuh ikan sebagai feses, urine, ekskresi insang dan panas. Energi yg hilang menjadi panas, sulit buat diukur, yakni:
1) Metabolisme standar, yaitu energi yang digunakan ikan pada kondisi tidak bergerak pada air yang tenang.
2) Aktifitas fisik sukarela, yaitu energi yang digunakan ikan untuk mencari makan, mempertahankan posisi dll.
3) Energi yang dikeluarkan berkenaan dengan aktifitas system pencernaan.
PENGETAHUAN GIZI
Seperti halnya fauna lain, ikan pun membutuhkan zat gizi tertentu untuk kehidupannya, yaitu buat membuat energi, menggantikan sel-sel yang rusak & buat tumbuh. Zat gizi yang diperlukan adalah : protein, lemak, karbohidrat, vitamin, mineral & air.
A. Protein
Protein sangat diperlukan oleh tubuh ikan, baik buat pertumbuhan juga buat menghasilkan energi. Protein botani (asal tumbuhtumbuhan), lebih sulit dicernakan daripada protein hewani (dari hewan), hal ini disebabkan lantaran protein botani terbungkus pada dinding selulosa yang memang sukar dicerna.
Pada umumnya, ikan membutuhkan protein lebih poly daripada fauna-fauna ternak pada darat (unggas dan mamalia). Selain itu, jenis & umur ikan juga berpengaruh pada kebutuhan protein. Ikan karnivora membutuhkan protein yang lebih banyak daripada ikan herbivora, sedangkan ikan hewan pemakan daging dan tumbuh-tumbuhan berada diantara keduanya. Pada umumnya ikan membutuhkan protein kurang lebih 20 ? 60%, dan optimum 30 ? 36%. Protein nabati umumnya miskin metionin, & itu bisa disuplau oleh tepung ikan yang kaya metionin.
B. Lemak
Nilai gizi lemak dipengaruhi oleh kandungan asam lemak esensialnya yaitu asam-asam lemak tak jenuh atau PUFA (Poly Unsaturated Fatty Acid) antara lain asam oleat, asam linoleat dan asam linolenat. Asam lemak esensial ini banyak terdapat di tepung kepala udang, cumi-cumi dll. Kandungan lemak sangat dipengaruhi oleh faktor ukuran ikan, kondisi lingkungan dan adanya sumber tenaga lain. Kebutuhan ikan akan lemak bervariasi antara 4 – 18%.
C. Karbohidrat
Karbohidrat atau hidrat arang atau zat pati, asal menurut bahan baku botani. Kadar karbohidrat dalam pakan ikan, bisa berkisar antara 10 ? 50%. Kemampuan ikan buat memanfaatkan karbohidrat ini tergantung pada kemampuannya untuk membentuk enzim pemecah karbohidrat (amilase). Ikan hewan pemakan daging umumnya membutuhkan karbohidrat sekitar 12%, sedangkan untuk hewan pemakan daging dan tumbuh-tumbuhan kadar karbohidratnya bisa mencapai 50%.
D. Vitamin
Jika ikan kekurangan vitamin, maka gejalanya adalah nafsu makan hilang, kecepatan tumbuh berkurang, rona abnormal, keseimbangan hilang, gelisah, hati berlemah, gampang terserang bakteri, pertumbuhan sirip kurang paripurna, pembentukan lendir terganggu dll. Agar ikan tetap sehat, suplai vitamin harus kontinyu, akan tetapi kebutuhan akan vitamin dipengaruhi sang berukuran ikan, umur, kondisi lingkungan & suhu air.
E. Mineral
Mineral adalah bahan an-organik yg diperlukan oleh ikan buat pembentukan jaringan tubuh, proses metabolisma dan mempertahankan keseimbangan osmotis. Mineral yg penting buat pembentukan tulang, gigi & sisik adalah kalsium, fosfor, fluorine, magnesium, besi, tembaga, kobalt, natrium, kalium, klor, boron, alumunium, seng, arsen, dll. Makanan alami umumnya telah relatif mengandung mineral, bahkan beberapa bisa diserap langsung berdasarkan dalam air. Namun pada biasanya, mineral-mineral itu dihasilkan menurut makanan. Oleh karena itu, beberapa macam mineral yg penting perlu kita masukkan pada proses pembuatan pakan.
Selain kandungan gizi, ada beberapa bahan tambahan dalam meramu pakan protesis. Bahan-bahan ini relatif sedikit saja, diantaranya : antioksidan, perekat & pelezat. Sebagai antioksidan atau zat anti tengik bisa ditambahkan fenol, vitamin E, vitamin C, etoksikuin, BHT, BHA & lain-lain dengan penggunaan 150 ? 200 ppm. Beberapa bahan dapat berfungsi sebagai perekat seperti supaya-agar gelatin, tepung kanji, tepung terigu & sagu, dengan pemakaian maksimal 10%. Bahan perekat ini menjadi penting pada pembuatan pakan udang, sebab pakan udang wajib memiliki ketahanan yg tinggi, agar tidak cepat musnah dalam air. Sebagai pelezat, dalam biasanya dipakai garam dapur sebanyak 2%.
Metoda Menghitung Kebutuhan Bahan Baku
Sebelum mulai menghitung, harap diingat bahwa suatu bahan baku disebut bahan sumber protein apabila kadar proteinnya > 20%. Karena harga protein paling mahal, maka yang pertama dihitung adalah protein, sedangkan yang lainnya menyesuaikan, misalnya dengan menambahkan sumber energi. Yang paling mudah adalah menggunakan metoda “Bujur Sangkar”.
Sebagai contoh, akan disiapkan pakan ikan mas menggunakan 25% protein, dari bahan dedak dan bungkil kedelai.
Untuk membuat pakan ikan mas 27% protein sebanyak 100 kg, kita wajib mencampur:
dedak : 17/35,8 = 47,5% x 100 = 47,5 kg
bungkil kedelai : 18,8/35,8 = 52,5% x 100 = 52,5 kg
Bila akan menggunakan lebih dari 2 bahan baku, kelompokkan dahulu bahan baku basal (kadar protein < 20%) dan bahan baku protein (>20%). Di rata-ratakan dahulu setiap kelompok, setelah itu dimasukkan ke metoda bujur sangkar.
(Protein dedak protein jagung) / dua = (8,dua 10,dua) / 2 = 9,2 %
(Bungkil kedelai tepung udang) / 2 = (44 48,35) / 2 = 48,35 %
Sehingga:
Bahan baku basal 21,35/39,5 = 54,53 %
Bahan baku protein 17,8/39,5 = 45,47 %
Jadi buat menciptakan 100 kg pakan ikan ini, dapat mencampur :
- Dedak : 27,265 kg
- Jagung : 27,265 kg
- Bungkil kedelai : 22,735 kg
- Tepung udang : 22,735 kg
SUMBER:
Masyamsir, 2001. Modul Membuat Pakan Ikan Buatan. Direktorat Pendidikan Menengah Kejuruan, Direktorat Jenderal Pendidikan Dasar dan Menengah, Jakarta.
REFERENSI:
Anggorodi, R., 1979. Ilmu Makanan Ternak Umum Gramedia, Jakarta, 1979
FAO, 1980, Fish Feed Technology. United Nations Development Programme, FAO United Nations, Rome, 395 P
Maynard, L.A., J.K. Loosli, H.F. Hintz, R.G. Warner, 1979, Animal Nutrition, Mc. Graw Hill., Inc. 602 P.
NRC, 1983, Nutrient Requirement of Warm Water Fishes & Shellfishes, National Academy Press, Washington DC. 102P
Rasyaf, M. 1990, Bahan Makanan Unggas di Indonesia Kanisius, Yogyakarta, 118 hal.
Rostika, R., 1997, Performan Juwanan Ikan mas yang dipengaruhi berbagai imbangan protein-energi pada pakan. Tesis Universitas Padjadjaran, tidak dipublikasikan, 145 hal.
Sumeru, S.U., dan Anna S., 1992, Pakan Udang Windu Kanisius, Yogyakarta, 94 hal.